
Научно-практический рецензируемый медицинский журнал «Фармакогенетика и фармакогеномика» издаётся с 2015 года и является официальным печатным органом Общества фармакогенетики, фармакокинетики и персонализированной терапии.
Журнал публикует оригинальные статьи о проведённых клинических, клинико-экспериментальных и фундаментальных научных работах, обзоры, лекции, описания клинических случаев, а также вспомогательные материалы по всем актуальным проблемам персонализированной медицины.
Основная тематика журнала сфокусирована на информировании врачей-клинических фармакологов, фармакологов, фармакокинетиков, биологов, организаторов здравоохранения, клиницистов, сотрудников фармацевтических фирм, учёных в интерес которых входят вопросы молекулярной медицины, и других специалистов об отечественных и зарубежных исследованиях генетических особенностей пациентов в формировании индивидуального фармакологического ответа при применении лекарственных препаратов у пациентов с различных заболеваниями. Это должно способствовать формированию у практикующих врачей компетенций по использованию фармакогенетического тестирования для персонализации применения лекарственных средств в реальной клинической практике.
Целевая аудитория
- клинические фармакологи
- фармакокинетики
- фармакологи
- биологи
- генетики
- клиницисты
- организаторы здравоохранения
- сотрудники фармацевтических фирм
Журнал «Фармакогенетика и фармакогеномика» включён в Единый государственный перечень научных изданий (ЕГПНИ) — «Белый список» — перечень научных периодических изданий, созданный в целях оценки публикационной активности при публикации основных научных результатов диссертаций на соискание ученых степеней и/или результатов научно-исследовательских работ, учитываемых при оценке результативности деятельности научных, образовательных организаций высшего образования, научных сотрудников и профессорско-преподавательского состава.
Журнал зарегистрирован в Федеральной службе по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) 04.02.2021 года свидетельство о регистрации СМИ ПИ № ФС 77 - 80350.
Текущий выпуск
ОТ ГЛАВНОГО РЕДАКТОРА
КЛИНИЧЕСКАЯ ФАРМАКОГЕНЕТИКА
ЭТНИЧЕСКИЕ АСПЕКТЫ ФАРМАКОГЕНЕТИКИ
Новости
2026-01-26
Только 14% специалистов в области психического здоровья обращают внимание на фармакогеномные сведения при назначении лекарств
 | К такому выводу пришли ученые из Великобритании в статье, опубликованной в научном журнале Nature. |
2026-01-24
Для ряда лекарственных средств риск нежелательных реакций зависит от генетических вариантов, влияющих на метаболизм и транспорт препаратов
 | Исследователи из Великобритании оценили, какая доля спонтанных сообщений о нежелательных реакций британской системы «Жёлтая карта» (Yellow Card, MHRA) относится к препаратам, для которых существуют клинические фармакогенетические рекомендации. |
2026-01-19
Глобальные тренды фармакогенетических исследований: где прогресс, а где «провалы» доказательной базы
 | Фармакогенетика давно стала частью персонализированной медицины, но в реальной клинической практике внедряется заметно медленнее, чем ожидалось. |
2026-01-19
II Всероссийская конференция «Клиническая фармакология в педиатрии», 2026 г.
 | В рамках ХХVII Конгресса педиатров России с международным участием «Актуальные проблемы педиатрии» 14 февраля 2026 г. будет проведена II Всероссийская конференция «Клиническая фармакология в педиатрии». |
2026-01-19
Фармакогеномика на перепутье: этические вызовы эпохи больших данных и редактирования генома
 | Фармакогенетика и фармакогеномика, являясь краеугольным камнем персонализированной медицины, вступают в период беспрецедентных возможностей и этических дилемм. |
2026-01-13
Актуальные вопросы доклинических и клинических исследований лекарственных средств и клинических испытаний медицинских изделий
 | 23-24 апреля 2026 года в Санкт-Петербурге состоится XIII Всероссийская конференция с международным участием «Актуальные вопросы доклинических и клинических исследований лекарственных средств и клинических испытаний медицинских изделий». |
2026-01-13
Фармакогенетическая стратегия назначения лекарственных препаратов в условиях реальной клинической практики доказала экономическую эффективность в международном исследовании
 | В журнале The Lancet опубликованы результаты масштабного многонационального исследования PREPARE, которые демонстрируют, что панельное фармакогенетическое тестирование (всего 12 генов и 50 фармакогенетических маркеров) перед назначением фармакотерапии является экономически эффективным и способствует снижению затрат на здравоохранение. |
2026-01-05
Глобальное исследование стратегий внедрения тестирования DPYD для безопасности терапии фторпиримидинами в онкологии
 | В журнале Clinical and Translational Science (2026) опубликованы результаты масштабного международного исследования, посвящённого стратегиям внедрения фармакогенетического тестирования DPYD перед назначением фторпиримидинов (5-фторурацил, капецитабин). В опросе участвовали 28 медицинских центров из 9 стран, включая США, страны Европы, Африки и Азии. |
2025-12-27
Массовое донорство гамет: биоэтический и медицинский анализ в свете инициативы П. Дурова и международного опыта
 | Массовое донорство гамет стало ключевым элементом вспомогательных репродуктивных технологий (ВРТ), порождая комплекс этических дилемм и медицинских рисков. Инициатива Павла Дурова (декабрь 2025 г.), предполагающая открытое донорство спермы с оплатой ЭКО и публикацией ДНК-данных, актуализирует эти вызовы, требуя сравнения с международными стандартами. |
2025-12-27
Генетические маркеры неэффективности и непереносимости метотрексата при псориазе: результаты российского исследования
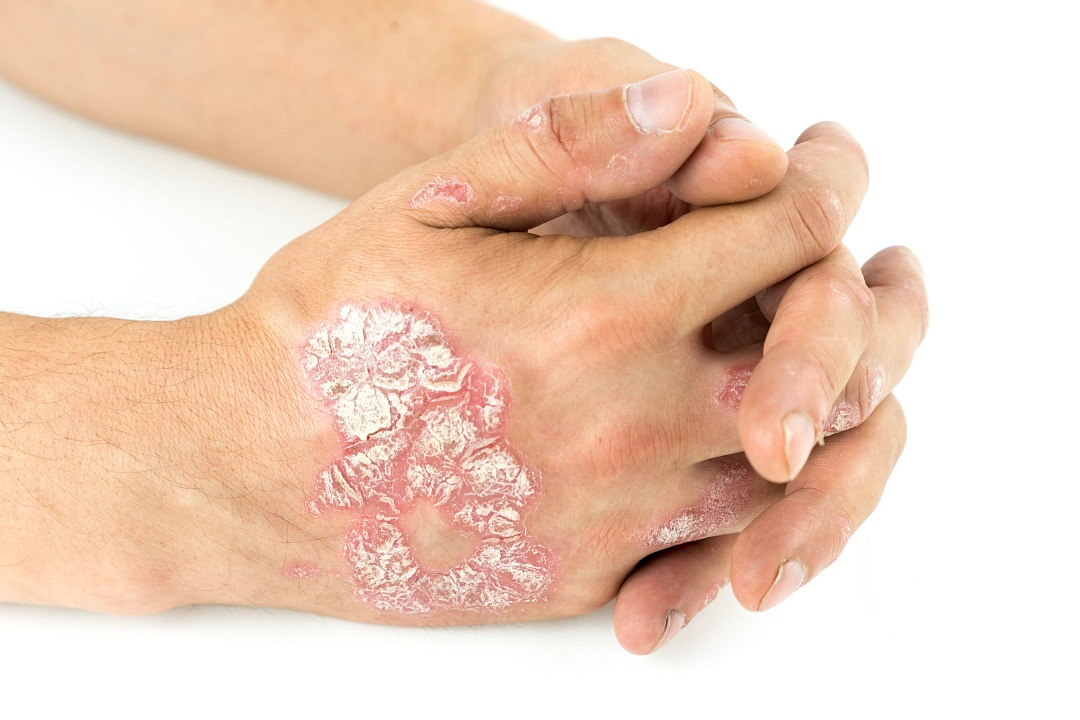 | Группа российских учёных под руководством академика Сычева Д.А., провела исследование, результаты которого опубликованы в высокорейтинговом журнале Journal of Personalized Medicine (Q1-Q2). |
| Еще новости... |










































